김명신가톨릭의대
결과를 공유하고 함께 다음 실험을 상의할 수 있고,
서로의 작고 큰 성공을 내 일처럼 기뻐하는 동료들이 있기에,
잦은 실패와 드문 성공에도 불구하고 끊임없이 연구로 향하게 된다.
“왜 연구를 하는가?” 라는 질문을 받을 때가 있다. 그럴 때는 그냥 웃기도 하고 “글쎄”하면서 말끝을 흐리는 걸로 답변을 대신하는데 나도 내가 연구를 하는 이유를 곰곰이 생각해보지 않은 것 같다. 돌아 보면 내 첫번째 논문은 전공의 1년차 초기에 당시 전임강사셨던 김용구 교수님으로부터 받은 망상적혈 구성숙 지표(reticulocyte maturity index, RMI)에 관한 것이었다. 예비군 훈련을 마치고 돌아오신 교수님께서 좋은 소식이 있다고 하시며 주제를 주셨던 기억이 난다. ‘예비군 훈련 중에 혈액내과 선생님과 연구 이야기를 했다니 매우 중요한 것인가 보다’ 라고 짐작해서 논문을 쓰겠다고 대답을 해버렸다 (대한임상병리학회지, 1997, Fig 1). 그렇게 얼떨결에 연구를 시작한 후 벌써 23년째 접어든다. 그러다 보니 작년에 진단검사의학회 학술상을 받는 기쁜 일이 있었고 지금 이 글을 쓰느라 끙끙대며 며칠째 책상 앞에 앉아있는 처지가 되었다.

Fig 1 대한임상병리학회지, 1997
첫번째 논문 이후로 석사, 박사 학위를 포함한 여러 가지 연구를 직접 수행하기도 하고 함께 공동연구에 참여할 기회가 많아졌다. 열 손가락 깨물어 안 아픈 손가락이 없다는 속담처럼 참여했던 연구와 논문은 마음 곳곳에 자리잡고 있다. 염색체 검사에서 나온 궁금한 점을 해결하기 위해 추가 실험이 필요했을 때선뜻 형광제자리부합법(fluorescence in situ hybridization, FISH) 시약(probe) 구입을 도와주시고 잘해보라고 하셨던 것, 실험이 잘되어 형광현미경에 장착된 필름카메라로 사진을 찍고(두 번 찍으면 형광 신호가 다 날아가는 상황) 잘 나왔을지 노심초사 하면서 확인했던 시간들은 아직도 느낌이 생생하다. 그 결과는 Acta Haematologica (2005)에 실리게 되었는데 지금 다시 보면 잘 나온 사진이 아니지만 나에게는 인생 작품 중 하나이다(Fig 2). FISH 기법을 이용하여 급성전골수구백혈병(acute promyelocytic leukemia, APL)에서 submicroscopic insertion 에 의한 PML::RARA 융합유전자를 찾은 연구는 골수 판독의 오래된 고민을 해결해준 전환점이 되었다. 우리 교실에서는 특이하거나 설명이 잘 안되는 증례를 ‘Interesting Case’ 라는 이름의 검은색 장부에 적어 놓는 전통이 있었다. 그 중 가장 많았던 것이 형태 학적으로는 확실히 APL로 보이는데 염색체나 FISH 에서 t(15;17)이 관찰되지 않는 경우였다. 이 때에도 FISH probe를 추가하여 실험을 하고 RT-PCR 로 확인함으로써 염색체 수준에서는 관찰되지 않는 PML::RARA가 존재함을 밝혀 Leukemia (2008)에 보고할 수 있었고 이후로는 비슷한 증례가 나와도 더이상 진단을 고민하지 않게 되었다. 이 연구를 기반 으로 세포유전, 분자유전 기법을 이용한 혈액 질환의 특성과 발병 기전을 밝히는 것이 우리의 주 연구분야로 자리잡게 되었다.
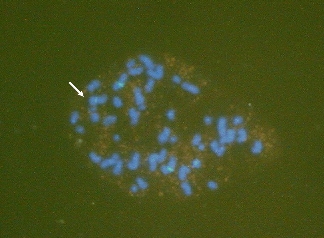
Fig 2 Acta Haematologica (2005)
그러던 중 2010년에 미국 Texas A&M Health Science Center의 Institute for Regenerative Med-icine으로 연수를 가게 되었다(Fig 3). 그 무렵 우리 기관은 가톨릭세포치료사업단을 설립하여 성체줄기 세포 연구와 임상시험을 적극적으로 지원하였는데 단장이신 오일환 교수님의 소개로 국제줄기세포 심포 지움에 발표 차 방문한 Prockop 교수님을 만나게 되었고 이를 계기로 함께 연구할 기회를 가질 수있었다. 동물실험실까지 갖춘 넓은 연구 공간에서 풍족한 시약과 장비를 이용해 다양한 실험을 할 수있던 것도 좋았지만 부족한 영어로 더듬거리며 Prock-op 교수님을 만나던 lab meeting 시간이 가장 기억에 남는다. 교수님은 노란색 Oxford Legal Pad를 주로 사용하셨는데 meeting을 시작할 때마다 연구의 목적을 글과 도표로 노트에 쓰면서 설명해 주셔서몇 번 지나니 연필 방향만 봐도 무슨 말씀을 하실지 알아차리는 영어(라고 하고 눈치라고 읽는) 실력을 갖게 되었다. 실험이 어느정도 진행되고 나서는 ‘Results’ 제목 아래에 Table 1, Table 2, Figure 1, Figure 2… 이렇게 써서 결과를 정리하기 쉽게 방향을 정해 주셨고 meeting 시간을 마무리할 때는 ‘도와줄 것이 있는지’ 물어보시곤 하였다. 새로운 연구를 계획할 때의 교수님의 눈빛과 실험 결과를 들으며 곰곰이 생각하여 해석해 주시던 모습은 연구를 즐기는 진정한 연구자 그 자체였던 것 같다. 나는 교수 님의 많은 것을 본받고 싶었는데 지금까지 노란색 Legal Pad를 연구 노트로 쓰는 것을 이어가고 있다 (쿨럭).

Fig 3 Texas A&M Health Science Center의 Institute for Regenerative Medicine
1년의 연수를 마치고 돌아와서 줄기세포 연구를 본격적으로 진행하게 되었다. 줄기세포(stem cell) 에대해서 주로 어떤 연구를 할 것인지 고민하였고, 너무 새로운 것을 시도하기보다는 그간 해왔던 연구와 결합하는 방향을 선택하였다. 그 중 하나는 줄기세 포의 유전체 불안전성에 관한 것이다. 줄기세포는 무한정 증식할 수 있는 것으로 생각되지만 실제로 계대배양을 반복하면 텔로미어 길이가 짧아지고 노화에 빠진다. 그 과정에서 유전체 불안정성이 발생하게 되는데 초기에는 진단검사와 연구를 통해 숙련된 염색체 핵형분석, FISH, 염색체마이크 로어레이(chromosome microarray, CMA) 기법을 사용하여 유전체의 변화를 파악하는 시도를 하였고 이후에는 RNA sequencing, whole exome sequencing, whole genome sequencing (WGS) 등을 추가로 도입하여 줄기세포의 유전체 변이와 그에 따른 기능변화를 연구하고 있다(Fig 4). WGS을 통해 계대배양에 따른 유전체 변이의 발생과 누적현상을 관찰하여 보고하였고(Scientific Reports, 2017), 줄기세포 노화의 방아쇠 역할을 하는 유비 퀴틴C의 작용 기전을 밝혀 Cell Death & Disease (2018)에 발표하였다. 또 하나는 혈액 질환 환자의 골수 내 중간엽기질세포(mesenchymal stromal cell, MSC)의 특성을 파악하는 연구 분야이다. 급성골수 백혈병(acute myeloid leukemia, AML), 골수형성 이상종양(myelodysplastic neoplasia, MDS), 다발 골수종(multiple myeloma, MM) 환자의 골수 MSC 를 분리 배양하여 정상인 MSC와 비교 분석하여 MDS/AML 환자의 골수 MSC가 조기 노화(early senescence)에 빠져있으며 이는 유전적/후성유전적 변화와 연관되어 있다는 사실을 발견하였다(Stem Cell Report, 2015). MM과 MDS 환자의 골수 MSC 를 비교한 연구에서는 두 질환 모두 골수 MSC가 조기노화에 빠진다는 공통점과 질환별 전사체 발현의 차이점을 발견하였고, 더 나아가 세포사멸을 조절하는 CDKN2A 유전자의 과발현에 의해 세포의 노화가 촉진되고 질병이 악화되는 기전을 밝히기도 하였다 (Cell Proliferation, 2020).
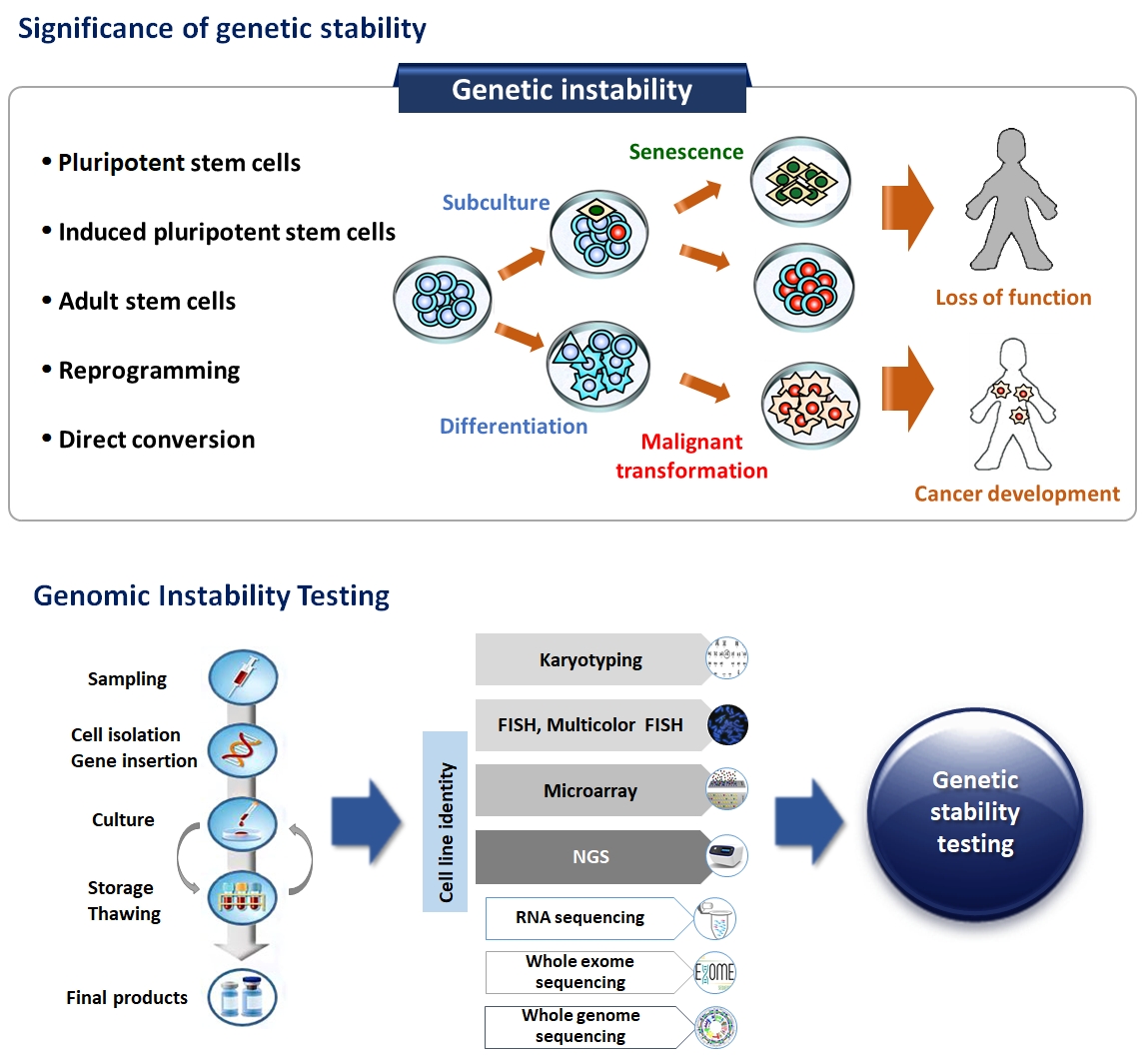
Fig 4 RNA sequencing, whole exome sequencing, whole genome sequencing (WGS)
이렇게 기초-이행성 연구를 하면서 혈액 질환에 대한 연구의 방향과 내용도 깊이를 더하며 자리를 찾아 가고 있다. 그간 여러 번의 실험을 통해서만 얻을 수있었던 유전자 변이 데이터는 CMA 그리고 차세대염 기서열분석(next-generation sequencing, NGS) 기법을 통해 한번에 대량으로 얻을 수 있게 되었고 짧은 기간 안에 바로 임상에 도입되고 있다. 여러 혈액 질환, 특히 혈액 종양의 유전자 프로파일과 변이의 임상적 의의는 한 두차례의 실험과 몇 번의 클릭 (아주 간단한 수준은 아니지만 예전에 비하면 훨씬 편리해진)을 통해 분석이 가능한 시대가 되었고 우리도 관련 논문을 몇 편 발표하였다 [Exp Mol Med (2019), Mol Diagn Ther (2020), Cancer Med (2020), Br J Haematol (2021), J Clin Med (2021), Bone Marrow Transplant (2021), J Clin Med (2022)-1, J Clin Med (2022)-2]. 아마 현재 데이터 정리 중인 것도 있을 것이 다. 최근에는 NGS를 이용하여 치료 후 미세잔존질환 (measurable residual disease, MRD) 추적을 시도하여 좋은 결과를 얻었고 다시 몇 편의 논문을 출판하였다 (J Clin Med (2019), Blood Cancer J (2021), Can-cers (2022), Front Oncol (2022)). 이 중 급성림프 모구백혈병(acute lymphoblastic leukemia, ALL) 과 MM에서의 IGH, IGK, TCR 유전자의 MRD는 신의료기술로 인정받았고 올해는 급여화가 되어 이제 많은 환자들에게 적용 가능하게 되었다. 나는 공학에 관심이 많고 새로운 기술이 소개되면꼭 써보고 싶어하는 편이다. 따라서 최근 핫이슈인 인공지능(artificial intelligence, AI)을 활용한 연구를 시도해 본 재미있는 경험이 있다. 우리는 AML, ALL 그리고 혼합표현형급성백혈병(mixed phenotype acute leukemia, MPAL)에서 전사체 데이 터를 생산하였고 델바인이라는 훌륭한 기술을 가진 기업과 함께 작업을 하여 AI 기계학습(머신러닝)으로 세가지 질환을 감별 진단할 수 있는 알고리즘을 공동 개발하였다. 이 알고리즘의 성능을 국제암유전체컨소 시엄(ICGC)과 미국국립생물정보센터(NCBI)의 427 개 데이터를 이용해 검증하였고 그 결과 진단 정확도가 99.1%로 높게 나타나 향후 임상에 적용할 수 있는 가능성을 보여주었다(Frontiers Oncol, 2021, Fig 5). 이후 더 정밀한 알고리즘을 개발하기 위하여 더 큰사이즈의 데이터를 많이 만들어서 연구를 시작하였 으니 나는 정말 못 말리는 사람인가보다 하는 생각이 든다.
나는 왜 연구를 하는가라는 질문에서 시작했는데 어떤 연구를 하는지 실컷 나열하는 글이 되어 가고 앞으로 어떤 연구를 할 것인지 말하면 끝이 안 날 것 같아서 이제 글을 마무리해야 할 것 같다. 진단검사 분야의 다양한 발전은 불가능했던 많은 것을 가능하게 하였고 이를 이용한 다양한 연구는 항상 나를 설레게 하고 기대하게 한다. 실험을 반복하고 결과를 분석해서 정리 하여 논문으로 발표하는 과정은 간혹 아니 종종 힘들고 더 나아가 의사와 환자들이 사용할 수 있는 수준 으로 진보시키는 것은 더 어렵다. 그럼에도 지치지 않고 지속해서 연구를 하는 동력은 무엇일까? 결과를 공유 하고 다음 실험을 상의할 수 있고, 서로의 작고 큰 성공을 내 일처럼 기뻐하는 동료들(실제 이번 학술상 수상도 나보다 다른 분들이 더 기뻐해주셨다)이 있기에, 잦은 실패와 드문 성공에도 불구하고 끊임없이 연구로 향하게 된다. 이 자리를 빌려 함께 하는 연구 동료(동지) 들께 깊이 감사드린다. 내가 연구가 무엇인지 왜 연구를 하고 있는지 답변을 잘 못해도 진단검사의학회 회원 님들께서 봐주실 것 같다. 연구는 어쩌다 보니 하고 있었고 하다 보니 재미도 있고 가끔은 의미도 있어서 좋다.
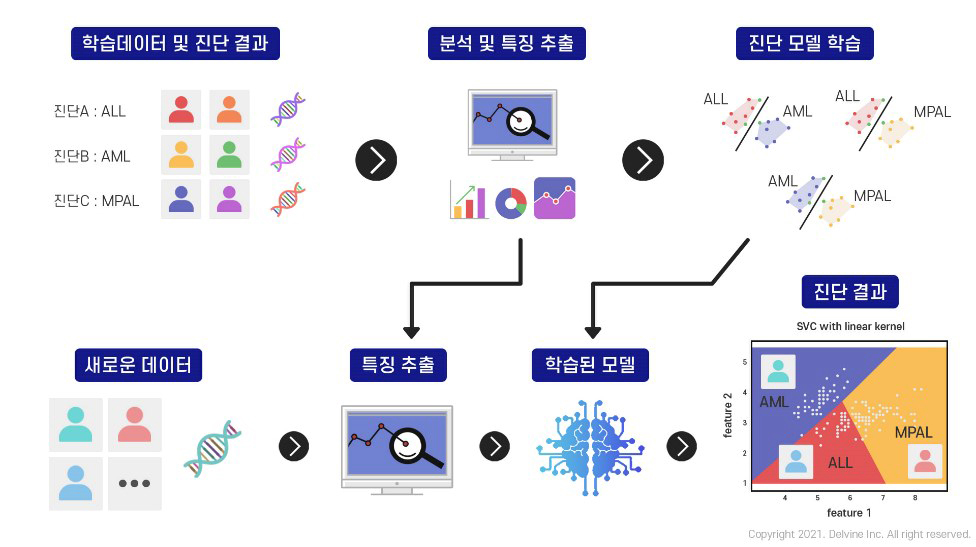 Fig 5 Frontiers Oncol (2021)
Fig 5 Frontiers Oncol (2021)


